Soft Particle의 강성 측정을 위한 단순한 구조의 유연 물질 센서의 개발
© Korea Robotics Society. All rights reserved.
Abstract
Increasing interest of human health, building bio-database (Bio DB) has been become a hot issue in life science. Consequently, Single Cell Analysis (SCA) which can explain biodiversity of lives has been a significant factor for building Bio DB. In numerous studies from these analyses, they have been showed that mechanical properties of cells can serve explanation of biological heterogeneity and criterion of disease states. Therefore, measuring mechanical properties of cells have great potential to be used in bio-medical applications. However, traditionally, many researchers have undergone difficult and time consuming work because handling small sized cells usually requires high-skilled technique. Thus, this paper shows robotized stiffness measurement technique using fixed ended beam sensor, precision motorized stage and substrate which have wall structure.
Keywords:
Single cell analysis, Cell mechanical stiffness, Fixed ended beam sensor, PDMS1. 서 론
최근 로봇 산업은 산업용 로봇을 넘어서 그 활용분야 를 다양하게 확장하고 있다. 특히 의료 산업과 생명공학 분야에서 사용하는 실험 장비에 로봇 기술을 응용하려 는 연구가 진행되고 있다. 예를 들어 단일 세포에 물질을 주입하기 위해서는 세포를 배양시킨 후 효소를 첨가하 여 개별 세포로 분리시키고 피펫(holding pipette)과 바늘 (injection needle)을 이용하여 물질을 정확한 위치에 주 입하는 정밀한 작업이 요구 된다. 이러한 작업은 작업자 의 숙련도에 영향을 많이 받는다[1]. 따라서 높은 정밀도 가 요구되는 고난이도 세포 조작에 로봇 머니퓰레이터 를 활용하여 정밀한 작업을 반복적으로 수행 할 수 있으 며, 로봇 머니퓰레이터에 말단 장치나 센서를 장착하여 다양한 작업을 수행 할 수 있다. 이와 같은 로봇 기술은 최근 다양한 연구가 진행되고 있는 단세포 분석(Single Cell Analysis, SCA)에도 효과적으로 적용 할 수 있다[2,3]. 예를 들어 혈액병은 단일 세포에서 발생하며[4-6] 세포의 기계적 특성이 질병 진행의 척도가 되므로[7-9] 힘 센서를 활용하면 단일 세포의 기계적인 특성을 효과적으로 측 정 할 수 있다.
단일 세포의 기계적 특성을 측정하기 위한 연구로는 마이크로 사이즈의 구조물[10,11], 외팔보[12], 양단 고정보[13] 와 같은 특수한 형상을 통해 단일 세포의 변형을 발생시 키고 그 변형을 통하여 강성을 예측하였다. 또한 원자력 현미경(Atomic Force Microscopy, AFM)에 연결된 미세바 늘을 이용하여 단일 세포의 부분 강성을 측정하였다[14]. 이외에도 전기이동 현상이 세포를 부풀린다는 점에 착 안하여 단일 세포의 강성을 측정하고자 하였다[7]. 그러 나 원자력 현미경과 초소형 피펫을 활용하는 경우에는 국부적으로 과도하게 변형이 발생 되므로 세포 전체의 강성을 측정하기 어려우며, 구조물의 변형을 활용하는 경우에는 복잡한 형상의 구조물이 필요하거나 구조가 단순하더라도 특정 위치에 힘을 집중하기 위해 센서의 말단이 예리한 형상을 가지게 된다[13,14]. 이로 인하여 상 대적으로 고강성 물질을 사용하여 센서를 제작하므로 측정 범위 역시 높아질 수밖에 없다. 그러나 일반적으로 세포의 강성은 낮은 영역에 존재하므로 폭넓은 측정을 하기에 어려움 점이 있다.
따라서 본 연구에서는 유연 물질과 간단한 구조를 활 용하여 단일 세포의 강성을 측정 할 수 있는 센서를 개발 하고자 한다. 본 연구가 기여하는 점은 다음과 같다.
- ▪ 양단 지지보의 센서구조물의 수학적 모델 도출
- ▪ 센서 구조물 형상 도출 및 제작
- ▪ 초정밀 로봇 플랫폼을 통한 세포의 강성 측정 결과
2. 기계적 강성 측정 원리
2.1. 측정 원리
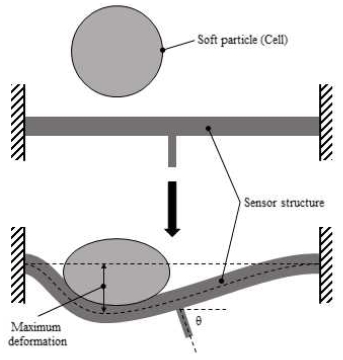
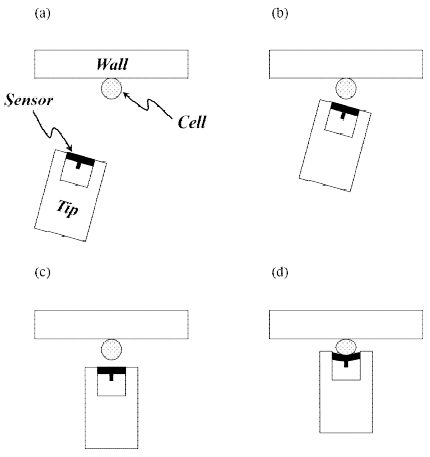
세포의 강성 측정을 위해서 Fig. 1과 같이 센서의 변형 을 이용하여 측정 대상물과 센서 사이에 작용하는 힘을 측정하고, 측정된 힘과 대상물의 변형을 바탕으로 강성 을 계산한다. 센서 구조물은 양단 고정보이며, 센서 구조 물을 이용하여 세포를 고정된 벽면에 압착 시킨다. 이때 세포와 센서 구조물 사이에 발생하는 힘으로 세포와 센 서 구조물은 각각 변형되는데, 센서 구조물의 최대 변형 량과 최대 변형이 발생한 위치 정보를 이용하며 발생한 힘은 계산 할 수 있다. 센서 구조물은 변형을 최대화 하 기 위해 유연한 물질로 제작 되어야 하며, T형상으로 제작하여 최대 변형이 발생한 위치 확인이 용이하도록 하였다.
2.2. 지배방정식
센서 구조물에서 발생하는 입․ 출력 물리량을 이용하 여 식 (1)~(2)와 같이 지배방정식을 유도할 수 있으며 각각 센서에 적용하는 힘(F), 측정 대상물의 강성(K ), 최대 변형이 발생하는 위치(x), 최대 변형량(υmax), 그리 고 측정 대상물의 변형량(Δd)을 의미한다.
| (1) |
| (2) |
2.3. 센서 구조물의 수학적 모델링
세포와 센서 구조물의 상호 작용하는 힘의 수학적 모 델을 도출하기 위해서 센서의 강성과 중립축에 대한 관 성 모멘트는 일정하며, 센서 구조물의 비틀림 거동은 무 시 할 수 있을 정도로 작으며, 작용하는 힘은 집중하중으 로 작용하며, 하중 작용점을 최대 변형 위치로 가정을 하였다. 따라서 양단 고정보의 평형 방정식은 식 (3)~(5) 와 같으며 각각 센서 양 끝단의 반력(Fa, Fb), 모멘트(Ma, Mb), 최대 변형 발생 위치(xmax), 센서의 총 길이(L ), 센 서의 영율(E ), 중립축의 2차 관성모멘트(I), 그리고 처짐 함수(υ(x))를 의미한다.M4
| (3) |
| (4) |
| (5) |
양단 고정보의 경계조건을 이용하여 하중작용점 좌측 의 처짐 함수는 식 (6)과 같으며 우측의 처짐 함수는 3차 다항함수를 이용하여 식 (7)과 같이 표현 할 수 있다.
| (6) |
| (7) |
이를 바탕으로 최대 변형량이 발생하는 지점에 작용 하는 힘을 식 (8)을 이용해 계산 할 수 있다.M9
| (8) |
| (9) |
세포의 강성은 식 (10)을 활용하여 계산할 수 있다.
| (10) |
3. 유연 물질 센서의 제작
3.1. 센서의 형상 및 재질
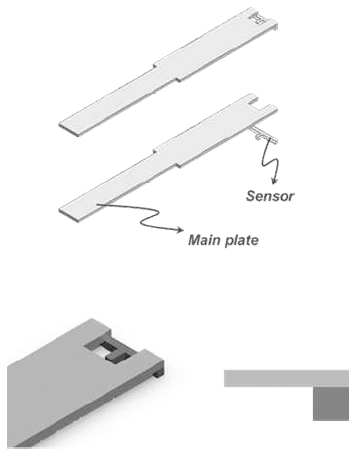
센서 구조물은 Sylgard 184 Elastomer kit (Dow Corning Corporation.)을 이용한 PDMS로 제작되었다. 인장시험 기를 이용해 테스트한 결과 평균 1.7 MPa의 강성으로 철이나 알루미늄과 같은 금속의 강성과 비교했을 때 상 대적으로 낮은 강성을 가지고 있었다. 센서의 형상은 Fig. 2와 같이 알루미늄으로 제작된 구조물에 센서의 본체를 부착하는 형태로 센서 모듈을 설계하였다. 센서 단면의 형상은 500 μm × 423 μm의 정사각형이며, 300 μm의 폭 과 800 μm의 길이를 가지는 꼬리가 장착되어 있었다.
3.2. 센서의 제작 공정
센서의 제작을 위해서 Fig. 3과 같이 단분자 형태의 탄성중합체(Sylgard 184 part A)에 경화제(Sylgard 184 B)를 10:1 비율로 섞은 후 PDMS에 잔존할 수 있는 기포 를 제거하기 위하여 원심탈포기에서 3분간 탈포를 진행 하였다. 이처럼 제작된 PDMS 탄성중합체는 테프론 시 트가 부착된 알루미늄판 위에 올려진 후 어플리케이터 (Elcometer 3570 Micrometer Film Applicator)를 이용해 필름의 두께를 결정하였다. 마지막으로 두께가 결정된 PDMS는 170°C오븐에서 10분 동안 경화되었다. 이 과정 을 통하여 단분자 형태의 탄성중합체가 고분자로 결합 하면서 일정한 두께의 PDMS 필름을 생성한다.
제작된 PDMS 필름을 물 분사 절단(water jet cutting) 방법을 이용하여 T 형상으로 절단하였다. 이 때 300 μm 폭의 꼬리부분이 함께 절삭되는 현상을 방지하기 위하 여 Fig. 4(a)과 같이 테프론 시트가 부착된 금속 플레이트 사이에 PDMS필름을 용접 압착한 후 Fig. 4(b)와 같이 절삭하였다.
4. 실험 결과
4.1. 초정밀 로봇 플랫폼
제작된 유연 물질 센서를 이용하여 세포의 강성을 측 정하기 Fig. 5와 같은 초정밀 로봇 플랫폼에 제작된 센서 를 장착하였다[15]. 초정밀 로봇 플랫폼은 Physic Instrument (PI)사의 스테이지를 이용하여 총 9자유도의 구현하였으 며 6개의 모터 스테이지와 3개의 압전 소자로 구동되는 스테이지로 구성되어 있다. 또한 센서가 세포에 접근하 는 과정과 센서의 변형을 관찰하기 위해 사용된 현미경 은 Olympus사의 BX51 TRF 정립 현미경이며 카메라를 활용하여 1360 × 1024의 해상도의 영상을 얻을 수 있으 며 현미경으로 관찰 할 수 있는 영상의 범위와 해상도는 Table 1과 같다.
4.2. 실험 방법
실험에 사용한 세포는 약 500 μm 크기의 제브라피쉬 (zebrafish) 배아(embryo)이며, 제브라피쉬 배아의 경우 살아있는 세포이므로 별도의 전처리 없이 실험을 수행 하였다. 다만 세포의 특성상 발생과정이 매우 빠르고 발 생이 진행됨에 따라 세포의 탄성이 급격히 감소하므로 발생 1일 미만의 세포만을 사용하였다.
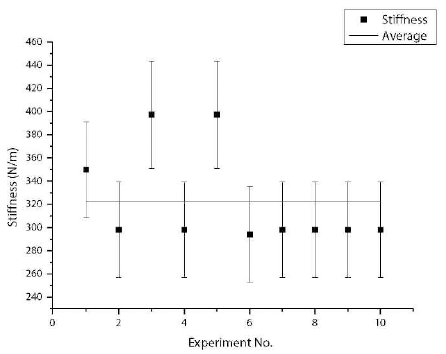
양단 지지보 형태의 센서 모듈은 Fig. 6과 같이 초정밀 로봇 플랫폼 말단 장치에 고정하였다. 세포의 강성을 측 정하기 위해서 Fig. 7과 같이 실험자가 로봇 플랫폼을 수동으로 조작하여 센서 구조물과 세포를 벽 구조물 주 위로 이송 한 후 세포를 압착하고, Fig. 8과 같이 센서 구조물과 세포의 변형 전후를 현미경을 이용하여 관찰 한다. 이때 얻어진 영상의 픽셀 데이터를 이용하여 센서 구조물의 최대 변형량과 세포의 변형량을 측정한다.
5. 결 론
본 고에서는 세포의 강성 측정을 위하여 유연 물질을 활용한 센서를 개발했다. 먼저 센서 구조물의 변형을 통 해 작용하는 힘을 계산하기 위하여 집중하중 모델을 이 용한 수학적인 모델을 도출하였으며, PDMS를 이용하여 센서 구조물을 제작하였다. 최종적으로 제작된 센서를 초정밀 로봇 플랫폼에 장착 한 후 실제 세포의 강성을 측정하는 실험을 수행 하였다. 하지만 힘이 센서 구조물 로 전달될 때 대부분의 힘이 꼬리 방향의 변형을 발생시 키지만 실제로 센서의 비틀림도 발생시키므로 측정값이 실제 대비 높게 측정될 가능성이 높아 최적 단면 형상에 대한 연구가 요구된다. 또한 센서 구조물과 세포 사이에 작용하는 힘은 집중하중 보다 분포하중으로 작용하며 엄밀하게 유연 물질의 단단함 정도를 나타내는 것은 재 료의 물성치인 영률로 표현해야 하므로 이를 고려한 수 학적 모델의 도출이 요구된다.
Acknowledgments
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea government (MSIP) (No. 2016R1A2B4009858)
References
-
Matt, Carter, Jennifer, C Shieh, “Guide to research techniques in neuroscience”, (2009), 1st ed, Academic press.
[https://doi.org/]

-
Daojing, Wang, Steven, Bodovitz, “Single cell analysis: the new frontier in ‘omics’”, Trends in Biotechnology, (2010), 28(6), p281-290.
[http://dx.doi.org/10.1016/j.tibtech.2010.03.002]

-
James, E Ferrell Jr, Eric, M Machleder, “The Biochemical Basis of an All-or-None Cell Fate Switch in Xenopus Oocytes”, Science, (1998), 280(5365), p895-8.
[http://dx.doi.org/10.1126/science.280.5365.895]

-
Michael, J Rosenbluth, Wilbur, A Lam, Daniel, A Fletcher, “Analyzing cell mechanics in hematologic diseases with microfluidic biophysical flow cytometry”, Lab on a Chip, (2008), 8(7), p1062-1070.
[http://dx.doi.org/10.1039/b802931h]

-
Alexey, Aprelev, Weijun, Weng, Mikhail, Zakharov, Maria, Rotter, Donna, Yosmanovich, Suzanna, Kwong, Robin, W Briehl, Frank, A Ferrone, “Metastable Polymerization of Sickle Hemoglobin in Droplets”, Journal of Molecular Biology, (2007), 369(5), p1170-1174.
[http://dx.doi.org/10.1016/j.jmb.2007.04.030]

-
Ulf, Bagge, Bjorn, Amundson, Claes, Lauritzen, “White blood cell deformability and plugging of skeletal muscle capillaries in hemorrhagic shock”, Acta Physiologica, (1980), 108(2), p159-163.
[http://dx.doi.org/10.1111/j.1748-1716.1980.tb06513.x]

-
Ning, Bao, Yihong, Zhan, Chang, Lu, “Microfluidic Electroporative Flow Cytometry for Studying Single-Cell Biomechanics”, Analytical Chemistry, (2008), 80(20), (2), p1062-1070.
[https://doi.org/]

-
Gabriel, YH Lee, Chwee, T Lim, “Biomechanics approaches to studying human diseases”, Trends in Biotechnology, (2007), 25(3), p111-118.
[http://dx.doi.org/10.1016/j.tibtech.2007.01.005]

-
Subra, Suresh, “Biomechanics and biophysics of cancer cells”, Acta Biomaterialia, (2007), 3(4), p413-438.
[http://dx.doi.org/10.1016/j.actbio.2007.04.002]

-
Kim, W, Han, A, “A Micro-Aspirator Chip Using Vacuum Expanded Microchannels For High-Throughput Mechanical Characterization of Biological Cells”, (2010), Proceedings of the 2010 International Conference on Miniaturized Systems for Chemistry and Life Sciences, Groningen, The Netherland, October 2010.
[https://doi.org/]

-
Xinyu, Liu, Wenhui, Wang, Bob, M Lansdorp, Yu, Sun, “Vision-Based Cellular Force Measurement Using an Elastic Microfabricated Device”, Proceedings of the 2006 IEEE/RSJ International Conference on Intelligent Robots and Systems, Beijing, China, October 2006.
[http://dx.doi.org/10.1109/IROS.2006.281926]

-
Bruno, Wacogne, Christian, Pieralli, Christophe, Roux, Tijani, Gharbi, “Measuring the mechanical behaviour of human oocytes with a very simple SU-8 micro-tool”, Biomedical Microdevices, (2008), 10(3), p411-419.
[http://dx.doi.org/10.1007/s10544-007-9150-7]

-
Mohd, Ridzuan Ahmad, Masahiro, Nakajima, Seiji, Kojima, Michio, Homma, Toshio, Fukuda, “Various Local Stiffness Characterizations of Single Cells using Buckling Nanoneedles”, Proceedings of the 2008 IEEE International Conference on Robotics and Biomimetics, Bangkok, Thailand, February 2009.
[http://dx.doi.org/10.1109/ROBIO.2009.4912979]

-
Tomohiro, Kawahara, Masakuni, Sugita, Masaya, Hagiwara, Yoko, Yamanishi, Fumihito, Arai, Hiroyuki, Kawano, Ikuko, Shihira-Ishikawa, Atsushi, Miyawaki, “On-Chip Force Sensing by Magnetically Driven Microtool for Measurement of Stimulant Property of P, laevis .
Proceedings of the 2011 IEEE International Conference on Robotics and Automation Shanghai China May, Proceedings of the 2011 IEEE International Conference on Robotics and Automation, Shanghai, China, May 2011.
[https://doi.org/]

-
Ihn, YS, Kim, Y, Choi, H, Lee, S, Koo, J, “Implementation of graspless handling system for microparticles using AFM probe”, Proceedings of the 2009 IEEE/RSJ International conference on intelligent robots and systems Sdt. Louis October, Proceedings of the 2009 IEEE/RSJ International conference on intelligent robots and systems, St. Louis, October, 2009.
[https://doi.org/10.1109/iros.2009.5354170]

2006 성균관대학교 기계공학부(공학사)
2008 성균관대학교 기계공학과(공학석사)
2013 성균관대학교 기계공학과(공학박사)
2013 ~ 2014 LG생산기술원 패터닝기술팀 선임연구원
2014 ~ 현재 한국과학기술연구원 로봇연구단 박사후 연구원
관심분야: Robot manipulator, Parallel mechanism, Mechanism design, Precision motion control
2011 성균관대학교 기계공학부(공학사)
2013 성균관대학교 기계공학과(공학석사)
2013 ~ 현재 현대자동자그룹 자동차부문 연구개발본부 안전성능개발2팀 연구원
관심분야: Bio-medical application, Flexible sensor
1989 한양대학교 기계공학과 (공학사)
1992 University of Texas at Austin, Mechanical Engineering(공학석사)
1997 University of Texas at Austin, Mechanical Engineering(공학박사)
1997 ~ 1999 삼성 Information System America Staff Engineer
1999 ~ 2001 IBM Storage Systems Division Advisory Engineer
2001 ~ 현재 성균관대학교 기계공학부 교수
관심분야: Modeling and simulation of physical systems, Precision mechatronics system, Computational mechanics, Sensor & Actuators